HDL und Altern
Eine niedrige HDL-Cholesterin-Konzentration ist einer der wichtigsten kardiovaskulären Risikofaktoren. In prospektiven Studien nehmen die HDL-Plasmakonzentrationen um etwa 1 % pro Lebensjahr ab, verbunden mit einer Einschränkung der protektiven Funktionen der HDL. Diese Reduktion ist von großer klinischer Bedeutung, da eine 1-prozentige Veränderung des HDL-Cholesterins das Risiko für Herzinfarkt oder Tod um 2 bis 3% ansteigen lässt. Die Gründe hierfür sind nicht geklärt. Es gibt derzeit auch keine pharmakologische Möglichkeit, die protektiven Effekte der HDL im Alter zu erhalten.
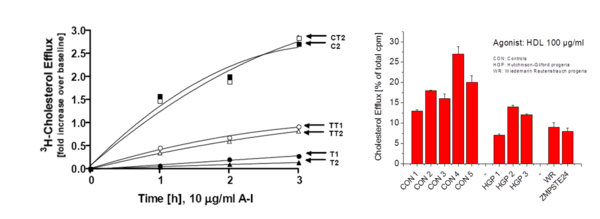
Wir konnten in vitro zeigen, dass der HDL-vermittelte Cholesterinefflux, eine wichtige protektive Funktion der HDL, in Fibroblasten von Patienten mit vorzeitiger Alterung, der Hutchinson-Gilford-Progerie (HGP), um etwa 50% reduziert ist (Abb. 1, rechts, unveröffentlicht). Die Patienten haben neben Zeichen der vorzeitigen Alterung etwa die Hälfte der normalen HDL-Konzentrationen im Blut und versterben zumeist vor ihrem 30. Lebensjahr an einer speziellen Form der Atherosklerose.
In mit humaner Telomerase (hTERT) immortalisierten HGP-Fibroblasten mit künstlich verlängerten Telomeren war der Cholesterinefflux deutlich verbessert. Auch bei einem anderen sehr seltenen HDL-Mangel-Syndrom, der Tangier-Krankheit (T in Abb. 1, links), ist der ABCA1-unabhängige Cholesterinefflux altersabhängig stark reduziert und kann durch hTERT (TT in Abb. 1, links) erhöht werden relativ zu den Kontrollen (C/CT in Abb. 1, links, Walter et al., 2004).
Wir gehen daher davon aus, dass der HDL Stoffwechsel ganz wesentlich durch replikative (d.h. von Telomerlänge und –funktionalität abhängige) Alterungsprozesse beeinflusst wird. Diese zu untersuchen ist Ziel dieses Projektes, um ein besseres Verständnis für mögliche protektive und therapeutische Maßnahmen zu erlangen.
Referenzen:
Lin H, Mensch J, Haschke M, Jäger K, Köttgen B, Dernedde J, Orsó E, Walter M.Establishment and characterization of hTERT immortalized Hutchinson–Gilford Progeria fibroblast cell lines. Cells 2022;11;2784.
Kannenberg F, Gorzelniak K, Jäger K, Fobker M, Rust S, Repa J, Roth M, Björkhem I, Walter M. Characterization of cholesterol homeostasis in telomerase-immortalized Tangier disease fibroblasts reveals marked phenotype variability. J Biol Chem. 2001;288:36936-47.
Walter M. Interrelationships among HDL metabolism, aging, and atherosclerosis.Arterioscler Thromb Vasc Biol. 2009;29:1244-50.
Walter M, Forsyth NR, Wright WE, Shay JW, Roth MG. The establishment of telomerase-immortalized Tangier disease cell lines indicates the existence of an apolipoprotein A-I-inducible but ABCA1-independent cholesterol efflux pathway. J Biol Chem. 2004;279:20866-73.
Beteiligte Wissenschaftler:



