Telomer-Positions-Effekt (TPE-OLD)
Es ist seit langem bekannt, dass bei sehr starker Telomerverkürzung über Sensormoleküle wie ATM, die nicht geschützte DNA wie auch echte Strangbrüche erkennen, eine DNA Schadens-Antwort induziert wird, die zum Zellzyklus-Stopp führt mit potentiell tumor-suppressiver Wirkung. Mit unseren Arbeiten konnte gezeigt werden, dass sich mitotische Zellen bereits bei mäßiggradiger Telomerverkürzung, also deutlich vor Induktion dieser DNA Damage Response, vor Stress und Entartung schützen können, indem es durch räumliche Umlagerung der Telomere bei zunehmender Telomer-Verkürzung zu Änderungen der Genexpression kommt. Dieser Effekt wurde als Telomer-Positions-Effekt „over long distances“, TPE-OLD, bezeichnet (Abb. 1)
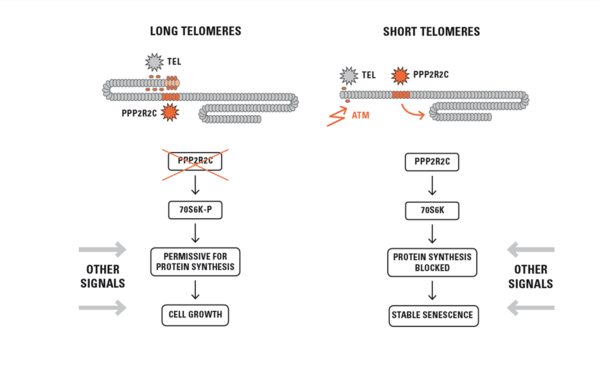
Wir konnten Tumor-Suppressorgene identifizieren, die über diesen Mechanismus ausschließlich bei verkürzten Telomeren exprimiert werden. Eines dieser Gene ist PPP2R2C, dessen Proteinprodukt (PR55y) den Zell-Stoffwechsel supprimiert und vor Krebs schützt. PPP2R2C wird bei langen Telomeren durch eine Loop-ähnliche Struktur inaktiviert und aufgrund einer Veränderung der chromosomalen Struktur bei kurzen Telomeren induziert.
PPP2R2C und weitere Tumorsuppressorgene, die unter einem TPE-OLD stehen, als mögliche therapeutische Targets zu charakterisieren, ist Fokus des Projektes „Telomere und Tumor-Suppressor-Mechanismen“. Wir beschäftigen uns in diesem Projekt primär mit den zugrunde liegenden Mechanismen des TPE-OLD an sich, der sich von ähnlichen Mechanismen bei Einzellern (hier als TPE bezeichnet) unterscheidet.
Referenzen:
1.) Jäger K, Mensch J, Grimmig ME, Neuner B, Gorzelniak K, Türkmen S, Demuth I, Hartmann A, Hartmann C, Wittig F, Sporbert A, Hermann A, Fuellen G, Möller S, Walter M. A conserved long-distance telomeric silencing mechanism suppresses mTOR signaling in aging human fibroblasts. Science Advances 2022;8:eabk2814.
2.) Lin H, Mensch J, Haschke M, Jäger K, Köttgen B, Dernedde J, Orsó E, Walter M. Establishment and Characterization of hTERT Immortalized Hutchinson-Gilford Progeria Fibroblast Cell Lines. Cells. 2022;11:2784.
3.) Hecker M, Fitzner B, Jäger K, Bühring J, Schwartz M, Hartmann A, Walter M, Zettl UK. Leukocyte Telomere Length in Patients with Multiple Sclerosis and Its Association with Clinical Phenotypes. Mol Neurobiol. 2021;58:2886-2896
4.) Habib R, Kim R, Neitzel H, Demuth I, Chrzanowska K, Seemanova E, Faber R, Digweed M, Voss R, Jäger K, Sperling K, Walter M. Telomere attrition and dysfunction: a potential trigger of the progeroid phenotype in nijmegen breakage syndrome. Aging 2020;12:12342-12375.
5.) Jäger K, Walter M. Therapeutic Targeting of Telomerase. Genes 2016;7:39
Beteiligte Wissenschaftler:




